PH
MARÍA JULIANA CASTILLO BEDOYA
QUÍMICA
Blog presentado a la docente
DIANA FERNANDA JARAMILLO CÁRDENAS
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
CIENCIAS NATURALES
IBAGUE
2018
INTRODUCCIÓN
En este blog daremos a conocer el concepto de ph, las características del ph, en donde se presenta el ph y unos ejemplos de este.
Lo que buscamos con este blog es profundizar los conocimientos acerca del ph, ademas es importante saber es el grado de concentración de iones hidrógeno en una sustancia o solución. El pHdel cuerpo es muy importante ya que controla la velocidad de las reacciones bioquímicas de nuestro propio cuerpo. El pH se mide en una escala del 1 al 14 que refleja la acidez de una sustancia: pH<7: Ácido.
OBJETIVOS
- Profundizar conocimientos acerca del ph
- Aclarar la importancia del ph
- Saber porque es importante medir el ph
MARCO TEÓRICO
Es una medida de acidez o alcalinidad de una disolución. El pH indica la concentración de iones de hidrógeno presentes en determinadas disoluciones. La sigla significa potencial de hidrógeno o potencial de hidrogeniones.
El valor del pH se puede medir de forma precisa mediante un potenciómetro, también conocido como pH-metro un instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio que es sensible al ion de hidrógeno.
El pH de una disolución se puede medir también de manera aproximada empleando indicadores: ácidos o bases débiles que presentan diferente color según el pH. Generalmente se emplea un papel indicador, que consiste en papel impregnado con una mezcla de indicadores cualitativos para la determinación del pH. El indicador más conocido es el papel de litmus o papel tornasol. Otros indicadores usuales son la fenolftaleína y el naranja de metilo.
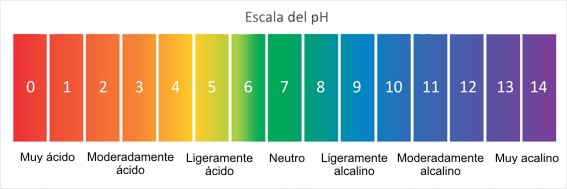
Los ácidos y bases tienen distintas concentraciones de iones de hidrógeno, siendo los más fuertes, aquellos que contengan mayor cantidad de iones y los débiles lo que no posean tanta concentración, siendo el pH el encargado de expresar el valor numérico de las concentraciones de iones de hidrógeno, en algunos casos la carga de iones suele ser bastante baja, lo que se vuelve tedioso al momento de trabajar con dichas cifras, es por ello que se ideó una tabla única, llamada la “escala del pH”, la tabla se encuentra compuesta por 14 unidades numeradas, desde el 0 hasta el 14, siendo el 0 el punto máximo de acidez y el 14 la base máxima, el 7 representa el punto medio de la tabla y es neutro, lo que quiere decir que las soluciones con un valor por debajo del 7 son ácidas y las que están por encima son básicas.
PROCEDIMIENTO
- Que es ph
- Características del ph
- El ph en el cuerpo humano
- El ph en e agua
- Escala del ph
- Ejemplo
QUE ES EL PH
Para saber qué es el pH te comentamos que es una forma en la que se expresa la acidez o alcalinidad de una sustancia. Esto se hace a partir de la concentración molar que ella tenga. Es entonces una unidad de medida para expresar y comprender la concentración de hidrógeno.
Realizando estudios en el agua, se logró determinar una escala que va desde 0 hasta 14. A partir de ella se establece entonces que los números menores a 7 son correspondientes a la acidez. Aquellos valores mayores a 7 expresan la alcalinidad de la sustancia y el 7 demuestra un valor neutro.
Se utiliza la sigla pH que significa el potencial hidrógeno de las sustancias para poder expresar los niveles de esta concentración en las mismas.
Es entonces que a principios del siglo XX se logran desarrollar una serie de definiciones. Estas aún tienen su validez en la actualidad y se extienden a todos los campos de la química moderna.
Ejemplo de esto sería medir el pH en la sangre. Un adulto posee un PH de 7,35 y 7,45 en la sangre. Si este se altera podría traer muchos cambios a los procesos que lleva a cabo tu cuerpo.
Para medir esto se debe utilizar el colorimétrico. Este es un método muy sencillo en el que se utilizan sustancias indicadoras del pH. El indicador más común para esto es el papel tornasol, se trata de una tira de papel que cuando la sumerges en una sustancia cambia de color.
Bien sea azul para las alcalinas o rojo para las soluciones ácidas. Esto es comparado con una cartilla de colores.
CARACTERÍSTICAS DEL PH
La principal característica diferenciadora entre estas sustancias radica principalmente en:
- Los ácidos por su parte son de sabor agrio, son acuosos y liberan hidrógeno cuando están en conjunto con metales. Estos tienen la propiedad de cambiar de un color azul a uno rojizo.
- Por su parte las sustancias alcalinas o bases son de un sabor amargo. También son sustancias resbalosas que cuando reaccionan a los metales forman hidróxidos. Estas sustancias cambian de color rojo a uno azul. Algunas de estas sustancias son la leche magnesia, el agua de mar, el polvo de hornear
El pH ademas es una característica de todas las sustancias determinadas por la concentración de iones de hidrógeno (H +). Cuanto menor es el pH de una sustancia, mayor es la concentración de iones H + y menor la concentración de iones OH-.
Según Arrhenius, un medio que presenta hidronios es ácido, y el que presenta hidróxidos es básico. Sin embargo, debemos relacionar la cantidad de ambos iones (H + y OH-), lo que hace que la clasificación de un medio siga estos principios:
Medio ácido: concentración de hidronios> (mayor) que la de hidróxidos.
Medio neutro: concentración de hidronios = (igual) a de hidróxidos.
Medio básico: concentración de hidronios < (menor) que la de hidróxidos.
Los valores de pH varían de 0 a 14, los valores por debajo de 0 y por encima de 14 son posibles, pero muy raros y no se pueden medir con los aparatos convencionales.
PH EN EL CUERPO HUMANO
mantener un equilibrio del pH del cuerpo es fundamental. El pH es una medida de la acidez o alcalinidad de una sustancia, y el del cuerpo se puede medir en sangre, orina o saliva.
El equilibrio entre lo ácido y lo alcalino en el organismo es fundamental, puesto que ciertas funciones del cuerpo –como por ejemplo la actividad de las enzimas digestivas– dependen del nivel del pH. La acidez y la alcalinidad se miden por el pH en una escala de 1 hasta 14, en la que el extremo de acidez es 1, y el extremo de alcalinidad, 14. Como en cualquier solución, los líquidos del cuerpo tienen un pH determinado, que deberá ser ligeramente alcalino y oscilar entre 7,35 y 7,45.
Actualmente, el estrés, el sedentarismo o los malos hábitos alimentarios provocan un desequilibrio: hacen que el pH del cuerpo baje y comportan además una de las principales causas de alteraciones de la salud. Por lo tanto, mantener el pH del organismo en el margen correcto es la clave para un buen funcionamiento del cuerpo.
El rendimiento deportivo se puede ver afectado negativamente si el cuerpo tiene el pH demasiado ácido, ya que, si esto ocurre, determinadas enzimas oxidativas y digestivas no pueden trabajar correctamente. Además, algunas publicaciones demuestran que, como el calcio almacenado en los huesos amortigua la acidez, si el cuerpo tiene un pH ácido, se libera calcio del hueso al torrente sanguíneo y esto puede provocar pérdida de masa ósea y problemas articulares.
En este sentido, la nutrición es un factor vital para lograr el estado óptimo de equilibrio ácido-base, ya que hay nutrientes con la capacidad de acidificar y otros con la capacidad de alcalinizar. Los alimentos se clasifican según el efecto que tienen dentro del cuerpo después de la digestión, y no según el pH que tienen por sí mismos; así, el sabor no es un indicador del pH que pueden generar dentro del organismo. Es el caso del limón: a pesar de saber ácido, tiene un efecto alcalino.
n líneas generales, las frutas y las verduras tienden a ser alcalinizan tes, mientras que los cereales, lácteos, legumbres y proteínas de origen animal suelen ser acidificantes. En este sentido, son muy importantes los minerales como micro nutrientes para mantener el equilibrio correcto; los podemos obtener diariamente a través de la dieta, pero también son eliminados a través del sudor, las heces y la orina.
Una buena manera de incorporar minerales a la dieta es ingerir verduras de hoja verde, frutas, algas, tofu, soja, sésamo y cereales integrales.

PH EN EL AGUA
El pH es una de las pruebas más comunes para conocer parte de la calidad del agua. El pH indica la acidez o alcalinidad, en este caso de un líquido como es el agua, pero es en realidad una medida de la actividad del potencial de iones de hidrógeno (H +). Las mediciones de pH se ejecutan en una escala de 0 a 14, con 7.0 considerado neutro. Las soluciones con un pH inferior a 7.0 se consideran ácidos. Las soluciones con un pH por encima de 7.0, hasta 14.0 se consideran bases o alcalinos. Todos los organismos están sujetos a la cantidad de acidez del agua y funcionan mejor dentro de un rango determinado.
El pH del agua pura (H20) es 7 a 25 °C, pero cuando se expone al dióxido de carbono en la atmósfera este equilibrio resulta en un pH de aproximadamente 5.2. Debido a la asociación de pH con los gases atmosféricos y la temperatura.
En general, un agua con un pH bajo < 6.5 podría ser ácida y corrosiva. Por lo tanto, el agua podría disolver iones metálicos, tales como: hierro, manganeso, cobre, plomo y zinc, accesorios de plomería y tuberías. Por lo tanto, un agua con un pH bajo corrosiva podría causar un daño prematuro de tuberías de metal, y asociado a problemas estéticos tales como un sabor metálico o amargo, manchas en la ropa, y la característica de coloración “azul-verde” en tuberías y desagües. La forma primaria para tratar el problema del agua bajo pH es con el uso de un neutralizador. El neutralizador alimenta una solución en el agua para evitar que el agua reaccionar con la fontanería casa o contribuir a la corrosión electrolítica; un producto químico típico de neutralización es el carbonato de calcio.
Un agua con un pH > 8.5 podría indicar que el agua alcalina. Puede presentar problemas de incrustaciones por dureza, aunque no representa un riesgo para la salud, pero puede causar problemas estéticos. Estos problemas incluyen:
La formación de sarro que precipita en tuberías y accesorios que causan baja presión del agua y disminuye el diámetro interior de la tubería.
- Provoca un sabor salino al agua y puede hacer que el sabor amargo al café;
- La formación de incrustaciones blanquecinas vasos y vajillas de cocina.
- Dificultad en hacer espuma de jabones y detergentes, y la formación de precipitados en la ropa.
Disminuye la eficiencia de los calentadores de agua. Típica mente se encuentran estos problemas cuando la dureza excede de 100 a 200 miligramos (mg) / litro (L) o ppm, que es equivalente a 12 granos por galón. El agua puede ser suavizada mediante el uso intercambio iónico, aunque este proceso puede aumentar el contenido de sodio en el agua.

ESCALA DEL PH
La escala de pH es logarítmica, por lo que cada cambio de la unidad del pH en realidad representa un cambio de diez veces en la acidez. En otras palabras, pH 6.0 es diez veces más ácido que el pH 7.0; pH 5 es cien veces más ácido que el pH 7.0.
EJEMPLOS:
*Zumo de limón
*Coca-cola
*Vinagre
*Limones
EJEMPLO 2:
*Zumo de naranja
*Zumo de manzana
*Pomelo
*Piña
*Fresa
*Uva
*Granada


No hay comentarios:
Publicar un comentario