NEUTRALIZACIÓN
MARÍA JULIANA CASTILLO BEDOYA
QUÍMICA
Blog presentado a la docente
DIANA FERNANDA JARAMILLO CÁRDENAS
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
CIENCIAS NATURALES
IBAGUE
2018
Introducción:
Por medio de este blog aprenderemos lo que es neutralización, las características de este, y las clases de neutralizacion que hay.}
Objetivos:
- Conocer los conceptos de neutralización
- Lograr comprender las características de la neutralizacion
- Aclarar con ejemplos de que se trata la neutralizacion
Marco teórico:
Acción y efecto de neutralizar o neutralizarse: anulación o moderación del efecto de una acción con su contraria. La neutralización es la disminución o anulación del efecto de cierta acción porque aparece otra contraria que la contrarresta: por ejemplo, si se bebe alcohol se puede producir una neutralización del efecto de un antibiótico que se ha tomado.
En química, la reacción química de un ácido con una base; el producto formado es: la sal correspondiente de estos compuestos y agua. La neutralización es un proceso químico mediante el cual una sustancia o un compuesto químico pierde sus propiedades ácidas o básicas; reacción química que se produce entre un ácido y una base para formar una sal y agua. En lingüística, el fenómeno definido originalmente en la fonología cuando una oposición entre dos fonemas deja de ser distintiva. En fonética, la pérdida de una oposición fonológica distintiva en un contexto fónico determinado.
En política, la situación del Estado que renuncia permanentemente a la guerra. Régimen de neutralidad permanente con que se coloca una ciudad o territorio. En deporte, la anulación de un periodo de tiempo o una parte de una competición deportiva, de manera que no tenga valor para el resultado final.
Acción y efecto de neutralizar o neutralizarse: anulación o moderación del efecto de una acción con su contraria. La neutralización es la disminución o anulación del efecto de cierta acción porque aparece otra contraria que la contrarresta: por ejemplo, si se bebe alcohol se puede producir una neutralización del efecto de un antibiótico que se ha tomado.
En química, la reacción química de un ácido con una base; el producto formado es: la sal correspondiente de estos compuestos y agua. La neutralización es un proceso químico mediante el cual una sustancia o un compuesto químico pierde sus propiedades ácidas o básicas; reacción química que se produce entre un ácido y una base para formar una sal y agua. En lingüística, el fenómeno definido originalmente en la fonología cuando una oposición entre dos fonemas deja de ser distintiva. En fonética, la pérdida de una oposición fonológica distintiva en un contexto fónico determinado.
En política, la situación del Estado que renuncia permanentemente a la guerra. Régimen de neutralidad permanente con que se coloca una ciudad o territorio. En deporte, la anulación de un periodo de tiempo o una parte de una competición deportiva, de manera que no tenga valor para el resultado final.
PROCEDIMIENTO:
- Que es neutralizacion
- Características
- Que es ácido y base
- Que es titulación
¿QUE ES NEUTRALIZACION?
Se llama neutralización a la reacción que se produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como producto una sal y agua.
La ecuación general que representa este tipo de reacción es:
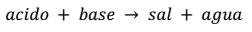
Por ejemplo, la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
Como se puede observar en la reacción, la sal se forma entre el anión () del ácido y el catión (K+).
Otra reacción de neutralización es la que se produce entre el ácido sulfúrico y el hidróxido de sodio.
Como se puede observar en la reacción, la sal se forma entre el anión () del ácido con 2 cationes (Na+) de la base, más 2 moléculas de agua.
La variación de entalpia (∆H) en las reacciones de neutralización entre ácidos fuertes y bases fuertes, es siempre la misma.
La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua.
La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
HCl + NaOH —-> NaCl + H2O
En este caso vemos al ácido clorhídrico contra el hidróxido de sodio. Genera cloruro de sodio y agua. En este caso basta una molécula de ácido con una molécula de la base para generar la sal. Pero no siempre es asi.
2 NaOH + H2SO4 —-> Na2SO4 + 2 H20
Aquí se necesitan 2 moléculas de la base contra 1 del ácido para formar el sulfato de sodio.
Este principio se usa para averiguar la molaridad de un ácido o de una base gracias a un procedimiento llamado valoración ácido base o titulación ácido base. Por ejemplo, si se quiere averiguar la molaridad de un ácido se coloca a la solución de este en un erlenmeyer y se la enfrenta con otra solución de un hidróxido de concentración excatmente conocida. Esta solución de la base se la coloca en una bureta quedando por encima del erlenmeyer que tiene la solución problema del ácido. Colocamos una gota de un indicador en el erlenmeyer para que nos indique el momento exacto en el cual se ha producido la neutralización, o sea, cuando no haya exceso de base ni ácido, por ejemplo la fenolftaleína. Dejamos caer gota a gota desde la bureta al Erlenmeyer haciendo movimientos suaves y circulares para una correcta titulación. Apenas vemos un cambio de coloración al rosa cesamos al agregado de la solución de hidróxido de sodio. Medimos el volumen agregado de la solución de NaOH y hacemos los cálculos correspondientes.
ácido base
Ejemplo: Se consumieron 60 ml de NaOH 0,4 M contra un volúmen de H2SO4 en el erlenmeyer de 100 ml.
Los moles agregados de NaOH son:
0,4 M x 0,060 litros: 0,024 moles
Según la reacción, la cantidad de moles de NaOH es el doble del H2SO4: Entonces de H2SO4 habrán 0,012 moles. La molaridad de H2SO4 será:
M = 0,012 moles / 0,1 litro (100 ml)
M = 0,12 M
CARACTERÍSTICAS
QUE ES ÁCIDO Y BASE
Los Ácidos son substancias de compuestos químicos que, al disolverse en agua, aumentan la concentración de iones H+” ya que tiene la capacidad de cederlos a alguien que puede cogerlos y que presentan las siguientes características:
- Tienen un sabor ácido o agrio.
- Provocan cambios de color en muchos indicadores (de color rosado-rojo) y en la tabla de pH les corresponden del número 1 al 6.
- Los no oxidantes reaccionan con los metales liberando hidrógeno.
- Reaccionan con las bases en un proceso denominado neutralización, en el que ambos pierden sus características.
- En las disoluciones acuosas, si los ácidos se encuentran ionizados, conducen la corriente eléctrica.
- Pueden crear nuevas sales y ácidos más débiles o volátiles reaccionando con ácidos más débiles o volátiles que ellos.
- Algunos ejemplos son: el vinagre o el zumo de limón,

Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
Las bases son substancias de compuestos químicos que, al disolverse en agua, aumentan la concentración de iones OH–“ y que presentan las siguientes características:
Tienen un sabor amargo.
Provocan cambios de color en muchos indicadores (hacia el verde-amarillo o azul) y en las tablas de pH les corresponden del número 6 o 7 al 12.
Son resbaladizos ya que tienen un tacto jabonoso.
Sus disoluciones acuosas conducen la corriente eléctrica ya que sus bases están ionizadas.
Reaccionan con los ácidos protónicos para formar sales y agua.
Algún ejemplo : la lejía

Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba(OH)2, etc
pH= 14 + log [OH-]
Bases débiles: Se trata de aquellas que no se disocian completamente.
Existen unas sustancias, llamadas indicadores, que generalmente son ácidos orgánicos débiles, éstas poseen la propiedad de cambiar de color cuando cambia la acidez de la disolución donde se encuentran.
Por ejemplo, el papel tornasol, cambia a color azul al ser introducido en una disolución de carácter básico, y a color rojo, si la disolución es ácida.
TITULACIÓN
Ácido + base → sal + agua
Ácido + base → sal + agua
Por ejemplo: HCl + NaOH → NaCl + H2O
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución.
Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.
Cuando tenemos una disolución con una cantidad de ácido desconocida, dicha cantidad se puede hallar añadiendo poco a poco una base, haciendo que se neutralice la disolución.
Una vez que la disolución ya esté neutralizada, como conocemos la cantidad de base que hemos añadido, se hace fácil determinar la cantidad de ácido que había en la disolución.
En todos los procesos de neutralización se cumple con la “ley de equivalentes”, donde el número de equivalentes del ácido debe ser igual al número de equivalentes de la base:
Nº equivalentes Ácido = nº equivalentes Base
Los equivalentes dependen de la Normalidad, que es la forma de medir las concentraciones de un soluto en un disolvente, así tenemos que:
N= nº de equivalentes de soluto / litros de disolución
Deduciendo : nº equivalentes de soluto = V disolución . Normalidad
Si denominamos NA, como la normalidad en la solución ácida y NB, la normalidad de la solución básica, así como VA y VB, como el volumen de las soluciones ácidas y básicas respectivamente:
NA.VA= NB. VB
EJEMPLOS
H2SO3 + Ca (HO)2 ----------> CaSO3 + 2 H2O
2) Sulfato de Magnesio
H2SO4 + Mg (HO)2 ------------> MgSO4 + 2 H2O
3) Nitrato de Aluminio
3[HNO3] + Al (HO)3 --------------> Al(NO3)3 + 3 H2O
4) Permanganato de Sodio
HMnO4 + Na (HO) ----------------> NaMnO4 + H2O
5) Sulfuro de Sodio
H2S + 2 Na (HO) ------------------> Na2S + 2 H2O
6) Bromuro de Plata
HBr + Ag (HO) ----------------> AgBr + H2O
7) cIoduro de Potasio
HI + K(HO) --------------> KI + H2O
8) Perclorato de Potasio
2[HClO4] + Ca (HO)2 --------------> Ca(ClO4)2 + 2 H2O
9) Cloruro Cuprico
2[HCl] + Cu(HO)2 -----------> CuCl2 + 2 H2O
10) Fosfato de Calcio
2[H3PO4] + 3 Ca(HO)2 -------> Ca3(PO4)2 + 6 H2O

Y LO QUE FALTA? LA PRESENTACION NO ES LA MEJOR 3,0
ResponderEliminarNO VEO LO QUE ARREGLO
ResponderEliminar