REACCIONES Y ECUACIONES QUÍMICAS
INTRODUCCIÓN:
Hablamos de reacción química cuando las moléculas de los reactivos rompen alguno de
sus enlaces para formar otros nuevos, lo que conlleva la aparición de nuevas sustancias.
Llamamos ecuación química a la expresión en la que aparecen como sumandos las
fórmulas de los reactantes (sustancias que reaccionan) seguidas de una flecha, y las
fórmulas de los productos (sustancias que se producen) también sumándose.
Deben incluirse los estados de agregación de las sustancias, aunque si todas están en
disolución o son gaseosas, se pueden obviar.
Para que se produzca la reacción es necesario que las moléculas de los reactantes
choquen entre sí, ya que es la única manera de que puedan intercambiar átomos para dar
los productos.
Ésta es una condición necesaria pero no suficiente ya que el choque debe
darse con una mímima energía para que los enlaces de los reactivos se puedan romper, y
con la orientación que les permita unirse para formar las moléculas de los reactivos. Si se
dan todas las condiciones hablaremos de choque efectivo.
OBJETIVOS:
-Entender qué sucede en una reacción química.
- Saber clasificar las reacciones.
- Ser capaz de realizar cálculos a partir de una ecuación química.
- Realizar e interpretar diagramas energéticos y cálculos con la energía de una
reacción.
- Comprender como afectan a la velocidad los factores que la modifican.
- Conocer algunas reacciones de importancia tanto en relación a la industria como
a la naturaleza.
MARCO TEÓRICO:
REACCIONES QUÍMICAS:
Una reacción química, también llamada cambio químico o
fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias
(llamadas reactantes o reactivos), se transforman, cambiando su estructura
molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes
pueden ser elementos o compuestos. Un ejemplo de reacción química es la
formación de óxido de hierro producida al reaccionar el oxígeno del aire con el
hierro de forma natural, o una cinta de magnesio al colocarla en una llama se
convierte en óxido de magnesio, como un ejemplo de reacción inducida.

CLASES DE REACCIONES QUÍMICAS:
En la naturaleza se presenta una gran cantidad de reacciones químicas que permiten la tranformación de la materia y la energía, permitiendo el debido funcionamiento de los sistemas. Consolidan así el principio básico de: la materia y la energía, no se crean ni se destruyen solo se transforma.
El gran número de reacciones que se presentan, por la regularidad de su procesos, se pueden clasificar en las siguientes clases de reacciones:
- Reacción de síntesis o combinación: Se presenta una reacción entre los reactivos ya sean elementos o compuestos, y se transforman en la unión de dichos elementos o compuestos en un sólo producto, por ejemplo, la ecuación demuestra que:
- Reacciones de descomposición.Se presenta en una ecuación, que a partir de un compuesto se obtienen dos o más sustancias simples, es decir:
- Reacciones de sustitución simple :Para éstas reacciones de sustitución o desplazamiento, los reactivos mas activos desplazan a los menos activos, ocupando el lugar del menor, explicado de la siguiente manera:
- Reacciones de desplazamiento doble :Se dá en una ecuación donde los dos reactivos se transforman en dos compuestos nuevos, sin cambiar el estado de oxidación de los elementos.
A la representación simbólica de cada una de las reacciones se le denomina ecuación química.
ECUACIÓN QUÍMICA :
Es una descripción simbólica de una reacción
química. Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas
productos). La ecuación química ayuda a visualizar los reactivos que son los
que tendrán una reacción química y los productos, que son las sustancias que se
obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada
uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
COMO SE ESCRIBE UNA ECUACIÓN QUÍMICA :
- Se determina cuales son los reactivos y los productos.
- Se escribe una ecuación no ajustada usando las fórmulas de los reactivos y de los productos.
- Se ajusta la reacción determinando los coeficientes que nos dan números iguales de cada tipo de átomo en cada lado de la flecha de reacción, generalmente números enteros.
CONCLUSIONES:
Las
reacciones químicas ocurren a nuestro alrededor cuando: encendemos un fósforo,
encendemos un auto, comemos la cena, o paseamos al perro. Una Reacciones Químicas es
el proceso por el cual las substancias se enlazan (o rompen el enlace) y, al
hacerlo sueltan o consumen energía. Una
ecuación química es la taquigrafía que los científicos usan para describir la reacción química.
Como ejemplo, tomemos la reacción del hidrógeno con el oxígeno para formar
agua. Si tuviésemos
un contenedor de gas de
hidrógeno y lo quemásemos con la presencia del oxígeno, los dos gases
reaccionarían juntos, soltando energía, para formar agua. Para escribir la
ecuación química de esta reacción, pondremos la sustancias que reaccionan
(los reactivos)
del lado izquierdo de la ecuación con una flecha apuntando a las substancias
que se forman al lado derecho de la ecuación (los productos).
WEB-GRAFÍA:
- https://es.wikipedia.org/wiki/Reacción_química
- http://www.iered.org/archivos/Proyecto_coKREA/REAfinales2014/ReaccionesQuimicas_MagalyHenao/clases_de_reacciones_qumicas.html
- https://es.wikipedia.org/wiki/Ecuación_química


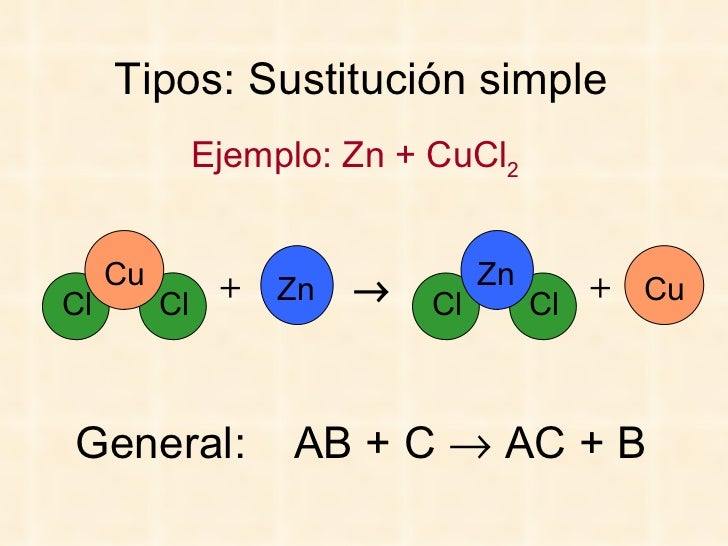
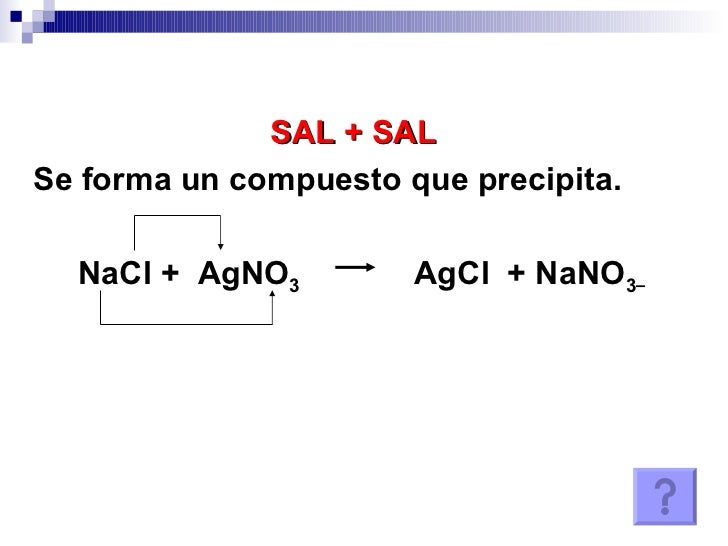
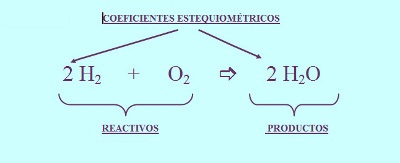
FALTO CLASIFICACION DE ACUERDO AL INTERCAMBIO DE CALOR Y MAS EJEMPLOS 4.5
ResponderEliminar